La inmensa mayoría de las reacciones químicas que tienen lugar en los seres vivos ocurren de modo regulado, es decir, su progreso se ajusta a las necesidades metabólicas de la célula en cada momento. Para que esto sea posible, es necesario que la velocidad a la que suceden tales reacciones pueda ser modificada, de modo que se retarden cuando los productos de la reacción no sean necesarios, o que se aceleren cuando haga falta producir más productos.
El control de la velocidad de una reacción química puede llevarse a cabo mediante la actividad de catalizadores. Precisamente, un catalizador es una sustancia que modifica la velocidad de una reacción química sin alterar otros parámetros de la misma (equilibrio, dirección de progreso, balance energético...), recuperándose al final de la reacción, como si no hubiera intervenido en ella.
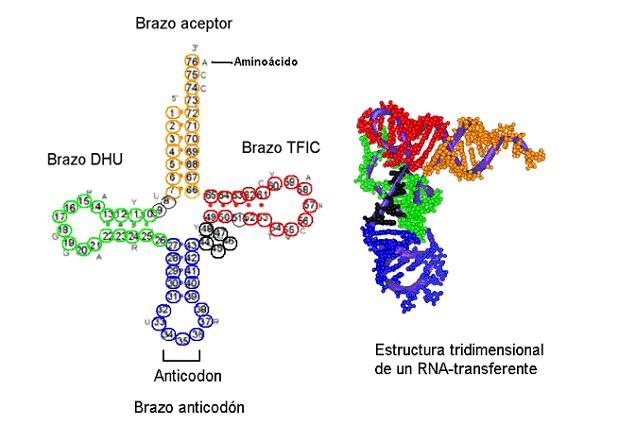
Los catalizadores biológicos por excelencia son las enzimas. En general, las enzimas son proteínas globulares que participan en el metabolismo de los organismos modificando la velocidad de reacciones específicas. Como excepción a esta norma, se conocen algunos ácidos ribonucleicos que también tienen actividad catalítica, y que reciben el nombre de ribozimas.
Mientras que en muchos casos las enzimas están formadas exclusivamente por aminoácidos, en otros muchos la proteína se encuentra asociada, además, a otro tipo de moléculas que resultan imprescindibles para que puedan desarrollar su función. Cuando esto ocurre, la enzima funcional, incluyendo la parte no proteica, recibe el nombre de holoenzima, la parte proteica se denomina apoenzima y la no proteica recibe el nombre genérico de cofactor.
Los cofactores pueden ser iones metálicos o moléculas orgánicas de pequeño tamaño.
El centro activo de las enzimas
Desde el punto de vista químico, la actividad de las enzimas consiste en modificar la energía de activación necesaria para que la reacción química tenga lugar. De ese modo se consigue que cambie la proporción de moléculas de sustrato que tienen suficiente para reaccionar. Para lograrlo, las enzimas forman un complejo con los sustratos, que actúa como intermediario de la reacción, que necesita una energía de activación menor para formarse, lo que significa que hay una mayor proporción de moléculas que pueden alcanzar ese nivel energético.
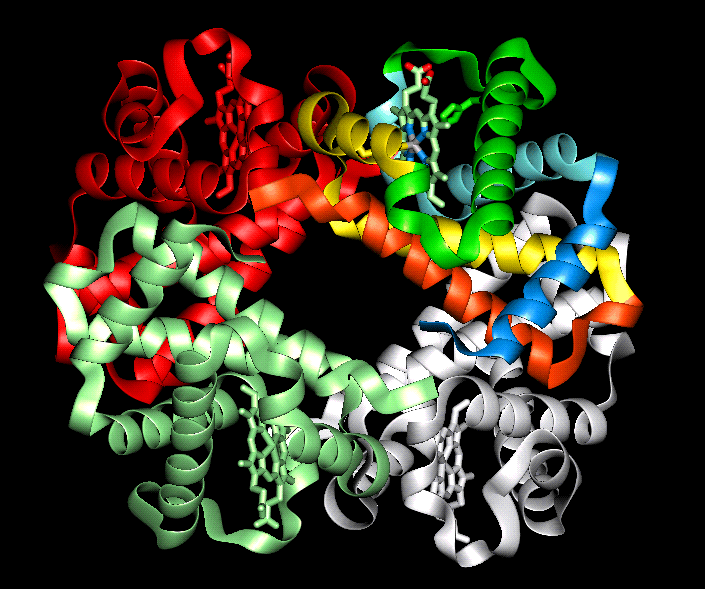
La unión entrela enzima y el sustrato ocurre en una región concreta de la enzima, que recibe el nombre de centro activo. Esta zona, que suele ser de pequeño tamaño respecto al volumen total de la proteína, está configurada por aminoácidos que pueden estar alejados entre sí en la secuencia primaria, pero que se encuentran próximos en la estructura terciaria, como consecuencia de los procesos de plegamiento. El resultado final de este plegamiento suele ser un "bolsillo" en cuyo interior encaja el sustrato de la enzima, gracias tanto a la complementariedad espacial entre sustrato y centro activo como al entorno químico que crean los aminoácidos de éste, que permite el establecimiento de interacciones débiles con la molécula de sustrato. El centro activo también incluye los cofactores cuando éstos forman parte de la enzima.
Los aminoácidos que se sitúan en el centro activo de la enzima desempeñan en él funciones diferentes:
Las enzimas se definen como biocatalizadores específicos, pero esta especificidad tiene dos facetas diferentes: por una parte, presentan especificidad de sustrato, es decir, una enzima se une a una molécula, pero no a otra similar a la primera. Este fenómeno se debe a la actuación de los aminoácidos estructurales y fijadores, que son los que se encargan de impedir que sustratos diferentes puedan encajar en el centro activo. El segundo tipo de especificidad es la especificidad de reacción, que consiste en que una enzima, una vez que se ha unido a su sustrato, cataliza una única reacción de todos los posibles cambios químicos que puede sufrir esa molécula. La especificidad de reacción se produce gracias a la acción de los aminoácidos ambientadores y catalíticos. Los primeros son los que se encargan de distorsionar la molécula de sustrato, haciéndola más susceptible a la reacción. Los aminoácidos catalíticos reaccionan directamente con el sustrato.
Mientras que en muchos casos las enzimas están formadas exclusivamente por aminoácidos, en otros muchos la proteína se encuentra asociada, además, a otro tipo de moléculas que resultan imprescindibles para que puedan desarrollar su función. Cuando esto ocurre, la enzima funcional, incluyendo la parte no proteica, recibe el nombre de holoenzima, la parte proteica se denomina apoenzima y la no proteica recibe el nombre genérico de cofactor.
- Las proteinas que incluyen iones metálicos en su estructura reciben el nombre de metaloproteínas, y representan aproximadamente entre la cuarta parte y la tercera parte de todas las proteínas conocidas. Los iones metálicos pueden unirse a la proteína directamente, mediante su coordinación con átomos de nitrógeno, oxígeno o azufre de los aminoácidos, o indirectamente, "atrapados" en un grupo formado por varios ciclos, en cuyo centro se encuentra el metal, como el grupo hemo. Entre los iones metálicos más comunes en las metaloproteínas se encuentran: Zn+2, Mg+2, Mn+2,Fe+2, Fe+3, Cu+, Cu+2, K+ y Na+. Estos iones participan en procesos como la expresión génica (cinc), la fotosíntesis (magnesio), o el transporte de electrones o de oxígeno (hierro), entre otros muchos. El papel concreto que desarrolla el metal dentro de la enzima es variable; en algunos casos, en particular en las reacciones de oxidación-reducción, el metal participa directamente en la reacción química (función catalítica primaria), mientras que en otras enzimas su papel consiste en establecer la unión entre el sustrato y la enzima, o en contribuir a la estabilización del centro activo.
- Las moléculas orgánicas que actúan como cofactores suelen ser derivados de bases nitrogenadas (tiamina, biotina, piridoxal) o de nucleótidos (FMN, FAD, NAD o NADP), aunque también hay algunas de naturaleza lipídica (coenzima A, coenzima Q, lipoamida). Generalmente estas moléculas actúan como intermediarios en la transferencia de grupos químicos, desde electrones a grupos funcionales. Es decir, el sustrato cede el grupo químico al cofactor y éste lo traspasa a una segunda molécula para formar el producto. Así pues, tienen fundamentalmente un papel catalítico primario. Muchas de estas moléculas no pueden ser sintetizadas por los animales superiores, por lo que tienen carácter esencial, razón por la cual se han incluido tradicionalmente en la categoría de "vitaminas".
El centro activo de las enzimas
Desde el punto de vista químico, la actividad de las enzimas consiste en modificar la energía de activación necesaria para que la reacción química tenga lugar. De ese modo se consigue que cambie la proporción de moléculas de sustrato que tienen suficiente para reaccionar. Para lograrlo, las enzimas forman un complejo con los sustratos, que actúa como intermediario de la reacción, que necesita una energía de activación menor para formarse, lo que significa que hay una mayor proporción de moléculas que pueden alcanzar ese nivel energético.
La unión entrela enzima y el sustrato ocurre en una región concreta de la enzima, que recibe el nombre de centro activo. Esta zona, que suele ser de pequeño tamaño respecto al volumen total de la proteína, está configurada por aminoácidos que pueden estar alejados entre sí en la secuencia primaria, pero que se encuentran próximos en la estructura terciaria, como consecuencia de los procesos de plegamiento. El resultado final de este plegamiento suele ser un "bolsillo" en cuyo interior encaja el sustrato de la enzima, gracias tanto a la complementariedad espacial entre sustrato y centro activo como al entorno químico que crean los aminoácidos de éste, que permite el establecimiento de interacciones débiles con la molécula de sustrato. El centro activo también incluye los cofactores cuando éstos forman parte de la enzima.
Los aminoácidos que se sitúan en el centro activo de la enzima desempeñan en él funciones diferentes:
- La mayoría de ellos participan en el establecimiento de la forma del centro activo, haciendo que sea complementaria del sustrato. Son, por lo tanto, aminoácidos estructurales.
- Un segundo grupo de aminoácidos contribuye a mantener el sustrato enlazado al centro activo. Para ello establece enlaces débiles con el sustrato, en lo que participan tanto sus cargas (aminoácidos ácidos o básicos) como su carácter químico (aminoácidos polares, aminoácidos hidrófobos). Estos grupos reciben el nombre de aminoácidos fijadores.
- Los aminoácidos ambientadores son los que contribuyen a crear un cierto entorno químico dentro del centro activo. Muchos sitios activos de las enzimas son bolsillos apolares, de modo que en esos casos los aminoácidos ambientadores tendrán esa naturaleza química.
- Los aminoácidos catalíticos son los que llevan a cabo la actividad enzimática. Para ello, participan activamente en la reacción química que ocurre dentro del centro activo, normalmente reaccionando con el sustrato y formando un compuesto intermedio, diferente al que se formaría en la reacción no catalizada. Al finalizar el proceso, los aminoácidos catalíticos recuperan su estructura.
Las enzimas se definen como biocatalizadores específicos, pero esta especificidad tiene dos facetas diferentes: por una parte, presentan especificidad de sustrato, es decir, una enzima se une a una molécula, pero no a otra similar a la primera. Este fenómeno se debe a la actuación de los aminoácidos estructurales y fijadores, que son los que se encargan de impedir que sustratos diferentes puedan encajar en el centro activo. El segundo tipo de especificidad es la especificidad de reacción, que consiste en que una enzima, una vez que se ha unido a su sustrato, cataliza una única reacción de todos los posibles cambios químicos que puede sufrir esa molécula. La especificidad de reacción se produce gracias a la acción de los aminoácidos ambientadores y catalíticos. Los primeros son los que se encargan de distorsionar la molécula de sustrato, haciéndola más susceptible a la reacción. Los aminoácidos catalíticos reaccionan directamente con el sustrato.