Si definimos estructura como la "disposición y orden de las partes dentro de un todo" podríamos considerar que la secuencia de aminoácidos de una proteína nos basta para determinar su estructura porque nos informa, precisamente, del orden en el que están dispuestos sus elementos. Sin embargo, aunque esto es cierto, también es insuficiente.
Como se comentaba en la entrada anterior, una proteína es una especie de varilla articulada rígida, de la que "cuelgan" fragmentos de moléculas. Ahora bien, esos fragmentos de moléculas, las cadenas laterales de los aminoácidos que forman la proteína, tienen características químicas que les hacen interactuar entre sí: los aminoácidos polares tienden a formar puentes de hidrógeno entre ellos, mientras que los aminoácidos hidrófobos tienden a alejarse de los polares, y a atraerse entre sí mediante interacciones hidrofóbicas. Los aminoácidos ácidos serán atraídos electrostáticamente por los básicos... En resumen, cada proteína es un pequeño "mundo" de fuerzas atractivas y repulsivas que, al sumarse "empujan" a los aminoácidos a ocupar determinada posición en el espacio, haciendo que las proteínas adopten una determinada forma tridimensional.
Así que tenemos, al menos, dos "niveles" en la descripción de la estructura de las proteínas: por una parte, su secuencia de aminoácidos. Por otra, la forma tridimensional de la proteína, que depende de su secuencia de aminoácidos, pero que no queda totalmente determinada por esa secuencia.
En realidad, el problema se complica aún más; se sabe desde hace tiempo que ciertas combinaciones de aminoácidos se ordenan en el espacio, adquiriendo formas geométricas regulares (hélices, láminas) y que, en muchos casos, fragmentos de una proteína que presentan esa forma regular actúan como "piezas" de construcción de la proteína, como "motivos estructurales" que se presentan en diferentes proteínas, para ayudarles a realizar funciones similares. Además, hay algunas proteínas que solo son funcionales cuando se asocian varias cadenas de aminoácidos producidas por separado.
En resumen, podemos establecer distintos "niveles" de estructura en el estudio de las proteínas. El primero de ellos, la estructura primaria, se refiere a la secuencia de aminoácidos que constituye la proteína. La estructura secundaria, que puede presentarse o no, corresponde a la existencia de partes de la proteína que poseen formas geométricas regulares. La estructura terciaria describe la forma que la proteína en su conjunto adopta en el espacio, mientras que la estructura cuaternaria, por último, describe si la proteína funcional consta de una o de varias cadenas de proteínas, y de cuáles son esas cadenas.
Hay una razón fundamental para preocuparse por el conocimiento de la estructura de las proteínas. Una de las "grandes ideas de la Biología", recogidas en otra entrada de este blog, es que los procesos que ocurren en las células necesitan que se produzcan interacciones entre moléculas con una gran especificidad, hasta el punto de que las moléculas que participan en tales procesos deben encajar perfectamente entre sí. (A menudo se usa la comparación con una mano y un guante). Las proteínas son las responsables de que ocurran la mayor parte de las interacciones moleculares dentro de la célula, por lo que la forma tridimensional que adquiera una proteína, así como las alteraciones que esa proteína pueda sufrir, son fundamentales para entender el funcionamiento de las proteínas.
Estructura primaria de las proteínas
La estructura primaria de las proteínas está determinada por la secuencia de los aminoácidos que forman la molécula, ordenados desde el aminoácido N-terminal hasta el C-terminal. La estructura primaria de las proteínas está determinada por los enlaces covalentes que se establecen entre sus aminoácidos, lo que incluye también a los enlaces que pueden establecerse entre cisteínas que se encuentran separadas en la secuencia de aminoácidos.
Los puentes disulfuro entre aminoácidos alejados en la estructura primaria contribuyen en una medida importante a que las proteínas consigan alcanzar su estructura tridimensional definitiva y a que la conserven una vez que la han alcanzado.
Estructura secundaria
En la mayoría de las proteínas existen algunos fragmentos cuyos aminoácidos se disponen forma regular, con una estructura geométrica concreta. Es necesario destacar dos aspectos de la estructura secundaria: en primer lugar, no se presenta en todas las proteínas. En segundo lugar, cuando aparece, no afecta a toda la proteína, sino solo a ciertas regiones de la misma.
Existen dos tipos fundamentales de estructuras secundarias en las proteínas: la hélice α y la hoja plegada o lámina β.
En la hélice α participan aminoácidos pequeños y polares, capaces de establecer entre sí enlaces por puente de hidrógeno que estabilizan la estructura. La cadena de aminoácidos gira en dirección dextrógira, quedando el esqueleto de la proteína hacia el interior mientras que las cadenas laterales se proyectan hacia el exterior de la hélice. La hélice da una vuelta completa cada 3,6 aminoácidos.
Los aminoácidos que forman parte de la hélice alfa siempre son contiguos en la estructura primaria de la proteína.
La lámina u hoja plegada β es el otro tipo de estructura secundaria que aparece en muchas proteínas. Se caracteriza porque varios segmentos de la proteína, separados entre sí en la estructura primaria, se disponen paralelos entre sí formando una "plancha" en la que los aminoácidos se encuentran prácticamente en un plano. Los diferentes fragmentos de la lámina se mantienen unidos entre sí mediante puentes de hidrógeno, y las cadenas laterales se proyectan por encima y por debajo del plano de la lámina.
En muchos casos varias estructuras secundarias se agrupan dentro de la misma proteína formando estructuras más complejas, llamadas "estructuras supersecundarias" o "motivos". Existen varios tipos de motivos más o menos complejos, como los que se recogen en las siguientes figuras:
La forma tridimensional de las proteínas, es decir, su estructura terciaria, es el factor que determina su funcionamiento: sea cual sea la función que realiza una proteína, su acción necesita que se produzca un contacto íntimo entre la molécula de proteína y otro compuesto o estructura, para lo cual la forma de ambas moléculas tiene que ser complementaria. Esta complementariedad de la forma de ambas moléculas se describe, en muchas ocasiones, comparándola con la relación que existe entre una mano y un guante; al igual que ocurre cuando nos ponemos una de estas prendas, el guante y la mano pueden cambiar de posición (y ligeramente de forma) hasta acoplarse perfectamente. Lo mismo ocurre cuando una proteína se une a su sustrato. La forma tridimensional en la que una proteína es activa es su conformación nativa.
La adquisición y el mantenimiento de la estructura terciaria de una proteína ocurre gracias al establecimiento de enlaces débiles entre los aminoácidos que la forman. Entre estas interacciones destacan los enlaces por puente de hidrógeno, que se forman entre aminoácidos polares, pero también son muy importantes las interacciones hidrofóbicas que se establecen entre los aminoácidos apolares. En este caso, además de las débiles fuerzas de atracción que tienden a atraer a estos aminoácidos entre sí, resulta también importante la repulsión que experimentan hacia el medio celular, de naturaleza acuosa y, por lo tanto, polar: los aminoácidos apolares tienden a mantenerse lo más alejados posibles del medio polar, lo que hace que se orienten hacia el interior de la proteína, mientras que los aminoácidos cargados o polares se sitúan en el exterior.
Proteínas fibrilares y globulares
Según la forma que adopta una proteína suele distinguirse entre proteínas fibrilares, que tienen forma alargada, similar a un hilo o un cable, y proteínas globulares, más o menos redondeadas. Usando el gadget que tienes a la derecha de este blog puedes ver la estructura terciaria de diferentes proteínas, siempre que conozcas el código que se usa para identificarlas (el código PDB). Puedes probar, por ejemplo, las siguientes:
Proteínas fibrilares
|
Proteínas globulares
| ||
Nombre
|
Código PDB
|
Nombre
|
Código PDB
|
Tropomiosina
Colágeno
|
1C1G
2KLW
|
Mioglobina
Triosa fosfato isomerasa
|
3H57
3GVG
|
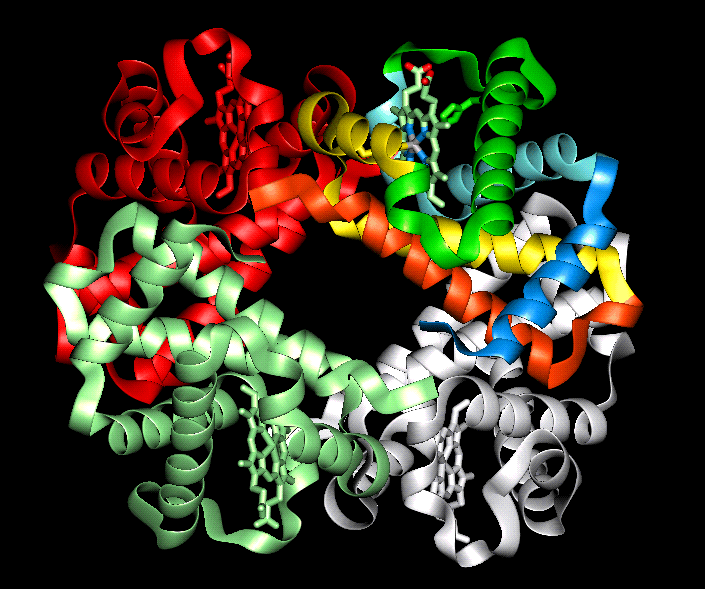
Estructura cuaternaria
Existen algunas proteínas que, en su forma funcional, están formadas por varias cadenas de aminoácidos unidas entre sí mediante enlaces débiles. Cada una de estas cadenas es una subunidad de la proteína completa. Las proteínas que poseen varias subunidades suelen denominarse proteínas oligoméricas.
Cada una de las cadenas que componen la proteína se forma por separado, y la unión ocurre solo después de que se hayan sintetizado. En muchos casos, además, esa unión es reversible y temporal: las subunidades pueden encontrarse separadas, con lo que la proteína no es activa, y solo cuando se da un estímulo determinado se produce la unión entre ellas (el ensamblaje) de la proteína, momento en el que la proteína comienza a realizar su función. El ensamblaje de las subunidades es, por lo tanto, un mecanismo que permite controlar la actividad de este tipo de proteínas.
La estructura cuaternaria de las proteínas oligoméricas describe el conjunto de subunidades que las forman: el número y tipo de cada una de las cadenas. Por ejemplo, la hemoglobina, la proteína que se encarga del transporte del oxígeno en la sangre, es una proteína oligomérica formada por cuatro subunidades, iguales dos a dos: dos reciben el nombre de alfa y las otras dos se llaman beta. Así pues, la estructura cuaternaria de la hemoglobina se describe, brevemente, indicando que es una proteína con estructura cuaternaria (α2β2). Algunas proteínas pueden estar constituidas por un número muy elevado de subunidades.
Ciclo de vida de una proteína
Las proteínas, como todas las moléculas, están sujetas a procesos de degradación que pueden hacer que se estropeen con el paso del tiempo, de modo que la célula tiene la necesidad de sustituirlas por otras copias en buen estado. El ciclo de vida de una proteína comprende todos los procesos que tienen lugar desde su síntesis hasta su eliminación y el reciclaje de los aminoácidos.
La síntesis de proteínas es un proceso complejo, que se produce en el ribosoma. Este proceso se analizará en profundidad en otro momento, pero hay que saber de él que la proteína adquiere en el ribosoma su estructura primaria, y que va abandonando esta estructura a medida que se va formando.
La estructura tridimensional es fundamental para que la proteína funcione. El gran número de interacciones posibles que pueden establecerse entre los aminoácidos hace que el plegamiento sea un proceso complicado, que empieza a producirse incluso antes de que termine la síntesis de la proteína.
Conforme la proteína va saliendo del ribosoma, debido a los movimientos de sus aminoácidos, se van estableciendo entre ellos los enlaces débiles que permitirán la formación de las estructuras de orden superior: secundaria y terciaria, así como (cuando existen), los puentes disulfuro entre cisteínas. El ambiente químico en el que ocurre este proceso es fundamental para el mismo, de modo que los aminoácidos hidrófobos tienden a atraerse entre sí, al tiempo que tratan de situarse lo más lejos posible del entorno polar del citoplasma (o del retículo endoplásmico), mientras que los aminoácidos polares y cargados tienden a situarse en el exterior.
En ocasiones, no es suficiente con el entorno celular para que la proteína adquiera su estructura terciaria adecuada. En esos casos intervienen las chaperonas, una familia de proteínas que se unen a los aminoácidos hidrófobos y ayudan a que la proteína se pliegue. Como los aminoácidos hidrófobos de las proteínas ya plegadas se encuentran en el interior de la proteína, las chaperonas solo se unen a las proteínas en formación.
Otra posibilidad que también puede tener lugar es la participación de las chaperoninas. En este caso, se trata de complejos multiproteicos que tienen forma aproximada de barril. En su interior se crea un entorno adecuado para que se produzca el plegamiento de las proteínas. Las chaperonas se unen a la proteína en formación y la transportan hasta el interior de la chaperonina, donde se consigue el entorno adecuado para el plegamiento de la proteína. Una vez terminado, la proteína, en su conformación nativa (la funcional) abandona la chaperonina.
En general, las proteínas son funcionales al terminar su proceso de plegamiento. En ese caso, se dice que la proteína ha alcanzado su conformación nativa, que es la estructura tridimensional en la que la proteína puede desarrollar sus funciones. Sin embargo, existen algunas proteínas que solo deben ser activarse tras un estímulo determinado. Por ejemplo, los factores de coagulación sanguínea, que solo deben alcanzar su conformación nativa después de que se haya producido una herida, o las enzimas digestivas, que solo deben activarse fuera de la célula, para ayudar a romper las macromoléculas ingeridas por la dieta.
En estos casos, la proteína sintetizada y plegada es un zimógeno, un precursor inactivo de la proteína funcional, con un fragmento de cadena que impiden que la proteína realice su función. Ese fragmento es eliminado cuando ocurre un evento desencadenante, por acción de otra proteína o de algún cambio químico que provoca la rotura del enlace correspondiente.
Las proteínas funcionales pueden perder su estructura tridimensional de forma accidental o programada. La pérdida de la conformación nativa de una proteína recibe el nombre de desnaturalización, y puede ocurrir por la acción de cualquier agente que sea capaz de alterar los enlaces débiles que fundamentan esta estructura: cambios en el entorno químico de la proteína (temperatura, pH, fuerza iónica) o en la propia proteína (oxidación, glicosilación...).
Por otra parte, las proteínas mal plegadas o desnaturalizadas son eliminadas por la célula, que recicla sus aminoácidos en la medida de lo posible. El proceso de rotura de una proteína recibe siempre el nombre de proteolisis. En la célula existen varios sistemas que permiten la proteolisis de las proteínas no funcionales: el lisosoma, un orgánulo en cuyo interior se encuentran varios tipos de proteínas hidrolíticas, incluyendo las que rompen proteínas, la ubiquitinación, proceso de reconocimiento e identificación de las proteínas que deben ser degradadas, las calpaínas, proteínas que se encargan de degradar a otras proteínas y los proteasomas, complejos de proteínas donde se degradan las proteínas unidas a la ubiquitina.
Algunas enfermedades importantes parecen ser debidas al plegamiento incorrecto de ciertas proteínas. Esto ocurre, por ejemplo, en el Alzheimer o en la enfermedad de las vacas locas.
Holoproteínas y heteroproteínas
Se denominan holoproteínas a las que están formadas exclusivamente por cadenas de aminoácidos, a diferencia de las heteroproteínas que incluyen, además, otros tipos de compuestos. Existen diferentes tipos de heteroproteínas, en función del tipo de compuesto que se une a las cadenas de aminoácidos: las lipoproteínas están formadas por lípidos y cadenas proteicas. Hemos hablado de ellas en el apartado de lípidos. Las glucoproteínas tienen glúcidos en su estructura. Incluyen proteínas expuestas en la superficie celular, proteínas que se encuentran en el sistema circulatorio y las proteínas de secreción. Las nucleoproteínas están formadas por la unión de proteínas y ácidos nucleicos. Forman parte del material genético en los organismos eucariotas. Por último, las cromoproteínas están formadas por la unión de una proteína y un pigmento, que les ayuda a realizar su función. Un ejemplo de este tipo de compuestos es la hemoglobina, que contiene un pigmento llamado tetraporfirina (con hierro), molécula que se encarga del transporte de oxígeno.