El ácido ribonucleico es un heteropolímero lineal no ramificado de ribonucleótidos, cada uno de los cuales está formado por una base nitrogenada (que puede ser adenina, citosina, guanina o uracilo), una molécula de ribosa y un grupo fosfato. Tiene tamaños muy variables, que van desde unas 80 bases a varios miles de ellas.
Una característica común a todos los ácidos ribonucleicos presentes en las células tanto procariotas como eucariotas es que son siempre de cadena simple, aunque pueden establecer uniones entre bases de la propia molécula para dar lugar a una estructura tridimensional característica.
En las células existen varios tipos de ARN diferentes, cada uno de los cuales tiene características propias:
- El ARN ribosómico (ARNr) forma parte de los ribosomas. Incluye moléculas de diferentes tamaños, con estructuras tridimensionales complejas, que participan activamente en la síntesis de proteínas. Se supone que al menos algunos de ellos tienen funciones catalíticas en este proceso.
- El ARN mensajero (ARNm) se forma en el núcleo, pero lo abandona para realizar sus funciones en el citoplasma. Su tamaño es bastante variable, y carece de estructura tridimensional definida; se une a los ribosomas para proporcionarles la información que necesitan para sintetizar proteínas.
- El ARN transferente (ARNt) es un conjunto de moléculas de pequeño tamaño, aproximadamente unas 80 bases, todas ellas con una estructura tridimensional parecida (en hoja de trébol). Se encuentran en el citoplasma, y pueden estar unidos a un aminoácido por uno de sus extremos. Se unen temporalmente al ribosoma, para transferir el aminoácido que llevan unido a la proteína que se está sintetizando.
- El ARN heteronuclear es una población heterogénea de ácidos ribonucleicos, que incluye todas las moléculas de este tipo de compuestos recién sintetizadas, y que se encuentran en el núcleo de las células eucariotas. Es el precursor del resto de los tipos de ácido ribonucleico.
 ARN mensajero
ARN mensajeroLos ARN mensajeros que se encuentran en la célula son siempre moléculas lineales, sin estructura secundaria. Su función consiste en llevar la información genética que codifica para la síntesis de proteínas.
Existe un ARN mensajero distinto para cada tipo de proteína que se produce en la célula. Cada molécula de ARN mensajero recoge la información de un solo gen, y en general incluye la información para una única proteína. El tamaño de las moléculas de ARN mensajero es muy diferente, según el tamaño de la proteína que codifiquen.
ARN ribosómico
Los ribosomas son cuerpos nucleoprotéicos, es decir, estructuras formadas por una combinación de proteínas y ácidos ribonucleicos formados por dos subunidades que pueden unirse o separarse en función de su actividad. Cada una de estas subunidades está formada, a su vez, por varios tipos de proteínas y varias moléculas distintas de ácido ribonucleico.

Cada tipo de ARN ribosómico presenta una estructura tridimensional diferente, relacionada con la función que realiza, igual que ocurre con las proteínas. En el establecimiento de dicha estructura espacial juegan un importante papel los enlaces por puente de hidrógeno que se forman entre bases de la misma cadena, según el principio de complementariedad de bases.

ARN transferente
Los ARN transferentes son una población de moléculas de pequeño tamaño que se encuentran en el citoplasma de la célula. En total hay 61 tipos de ARNt (cifra que tiene importancia en el proceso de síntesis de proteínas). En la célula, los ARNt pueden encontrarse en dos formas: unidos o no unidos a un aminoácido. Su función en la síntesis de proteínas consiste, precisamente, en "transferir" ese aminoácido a la cadena de proteína que se está formando, de acuerdo con la secuencia del ARN mensajero que se lee en cada momento.
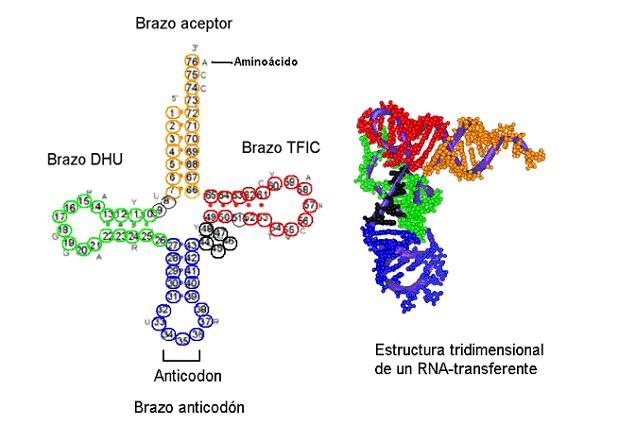
Todos los ARN transferentes tienen una estructura secundaria similar, llamada en "hoja de trébol", que da lugar a una estructura terciaria similar a una "L".
Dentro de la estructura del ARNt hay dos zonas que tienen una importancia fundamental en el proceso de síntesis de proteínas: el brazo anticodon, que "lee" la secuencia de nucleótidos del ARN mensajero con información suficiente para indicar el aminoácido que debe incorporarse a la proteína, y el brazo aminoacil, la zona por donde se une dicho aminoácido al ARNt.
Papel biológico del ARN
En la célula, el ADN se encarga de almacenar y transmitir la información genética, necesaria para llevar a cabo la síntesis de las proteínas que la célula utiliza en cada momento y para controlar todos los procesos biológicos. El ARN tiene un papel central en el proceso de plasmación de la información almacenada en el ADN, actuando en todos los procesos que permiten construir una proteína a partir de la información contenida en el ADN.

Papel biológico del ARN
En la célula, el ADN se encarga de almacenar y transmitir la información genética, necesaria para llevar a cabo la síntesis de las proteínas que la célula utiliza en cada momento y para controlar todos los procesos biológicos. El ARN tiene un papel central en el proceso de plasmación de la información almacenada en el ADN, actuando en todos los procesos que permiten construir una proteína a partir de la información contenida en el ADN.
- El ARN mensajero traslada la información de un gen concreto desde el ADN hasta el ribosoma. La célula no lee simultáneamente toda la información que posee, sino solo la que corresponde a las proteínas que necesita en cada momento. Ese fragmento de información (gen) se copia en una molécula de ARN, en un proceso que se denomina transcripción. Luego, la molécula de ARN mensajero se traslada hasta el ribosoma, donde su información va a ser leída y utilizada para sintetizar una proteína.
- El ribosoma "lee" la información presente en el ARN mensajero, y en función de la misma sintetiza una cadena de aminoácidos (proteína). Para ello, hace corresponder cada elemento de información del ARN mensajero con el aminoácido que codifica, y luego los une secuencialmente para formar la proteína. El ARN ribosómico juega, en este proceso, un doble papel: estructural, ya que contribuye a dar la forma adecuada al ribosoma, y catalítico, porque se sabe que ocupa el sitio catalítico de esta estructura.
- En cuanto al ARN transferente, se encarga de "traducir" la información contenida, en forma de secuencia de nucleótidos, en el ARN mensajero en los aminoácidos correspondiente. Dicha traducción se hace "palabra por palabra", es decir, cada grupo de nucleótidos equivale directamente a un aminoácido, y el ARN transferente hace de intermediario entre ambas secuencias, relacionándolas entre sí. Cada uno de los tipos de ARN transferente presentes en la célula corresponde a un elemento de información de los ácidos nucleicos, concretamente a tres bases (conjunto que se denomina codón), cantidad de información mínima necesaria para permitir el uso de los veinte aminoácidos presentes en las proteínas. Las bases del brazo anticodón de cada ARNt son diferentes, y complementan a los diferentes codones del ARNm. Los tres anticodones que faltan (hay 64 codones posibles) corresponden a la señal de finalización de la proteína. El sitio de unión a los aminoácidos sirve para incluir cada aminoácido en su lugar correspondiente en la proteína. Cada secuencia del brazo anticodón equivale a un único aminoácido. Esta equivalencia constituye el código genético.